FDA concede à Suzhou CH Biomedical a aprovação para iniciar ensaios clínicos com o sistema de assistência ventricular esquerda BrioVAD™, prometendo soluções inovadoras para insuficiência cardíaca.


Recentemente, a Suzhou CH Biomedical, Inc. anunciou que seu sistema de assistência ventricular esquerda totalmente levitado magneticamente, BrioVAD™, recebeu a aprovação da FDA dos EUA para realizar ensaios clínicos. O ensaio clínico de marco, denominado INNOVATE, obteve a Isenção de Dispositivo Investigacional (IDE) da FDA, permitindo o início condicional da recruta de pacientes.
Este estudo avaliará a eficácia e a segurança do BrioVAD™, um novo sistema de assistência ventricular esquerda totalmente levitado magneticamente desenvolvido pela CH Biomedical, no tratamento da insuficiência cardíaca refratária. Enquanto isso, a CH Biomedical convocou a primeira reunião de investigadores para o estudo e iniciou o trabalho de preparação relacionado aos centros de ensaios clínicos nos Estados Unidos.

▲ CH Biomedical realiza a primeira reunião de investigadores para o ensaio clínico INNOVATE
O sistema de assistência ventricular esquerda BrioVAD™, aprovado pela FDA nos Estados Unidos, baseia-se na excelente compatibilidade sanguínea do produto existente, CH-VAD. Através de várias inovações tecnológicas, alcança a portabilidade dos componentes externos enquanto melhora ainda mais o desempenho geral do sistema. Além disso, o estudo INNOVATE empregará um design controlado randomizado para comparar e avaliar o BrioVAD™ com produtos previamente aprovados pela FDA.
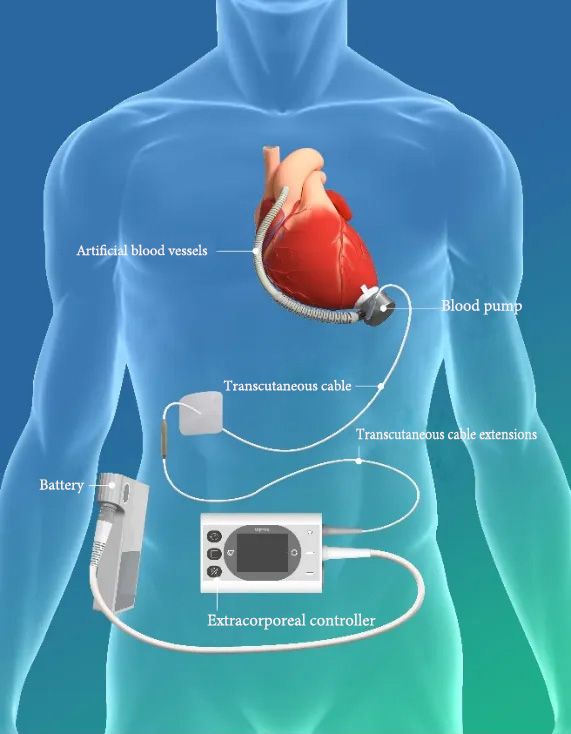
▲ Esquemático do produto BrioVAD™ Sistema de Assistência Ventricular Esquerda
CH-VAD é o primeiro dispositivo de assistência ventricular esquerda implantável totalmente levitado magneticamente desenvolvido na China. Desenvolvido conjuntamente pela equipe do Hospital Fuwai e a CH Biomedical, pesa 186g, com um diâmetro da bomba de sangue de 50mm, espessura de 26mm e taxa de fluxo máxima de 10L/min. A tecnologia central deste produto envolve principalmente a tecnologia de bomba de sangue totalmente levitada magneticamente, que obteve várias patentes na China e nos Estados Unidos, tornando-se um dispositivo médico pioneiro nacionalmente. Em comparação com produtos internacionais semelhantes, seus principais indicadores de desempenho alcançaram o mesmo nível, com tamanho de bomba menor e melhor invasividade do implante.
O CH-VAD está disponível clinicamente desde 2018 e recebeu aprovação da NMPA para uso com vasos sanguíneos artificiais específicos em 2021, fornecendo suporte mecânico para a circulação sanguínea de pacientes com insuficiência cardíaca refratária em estágio terminal, utilizado como terapia transitória antes do transplante cardíaco ou para recuperar a função cardíaca.

▲ Sistema de Assistência Ventricular Esquerda Implantável CH® (CH-VAD)
O CH-VAD consiste em componentes internos do implante, componentes externos de transporte, componentes periféricos e ferramentas cirúrgicas especializadas. É um dispositivo eletromecânico integrado usado para substituir parcialmente a função de bombeamento do coração e manter a circulação sanguínea humana. Seu componente central é uma bomba de sangue que retira o sangue do coração, aumenta sua pressão e o entrega à aorta, descarregando a carga de trabalho do coração natural, permitindo-lhe descansar, enquanto também suplementa a capacidade de bombeamento insuficiente do coração natural.
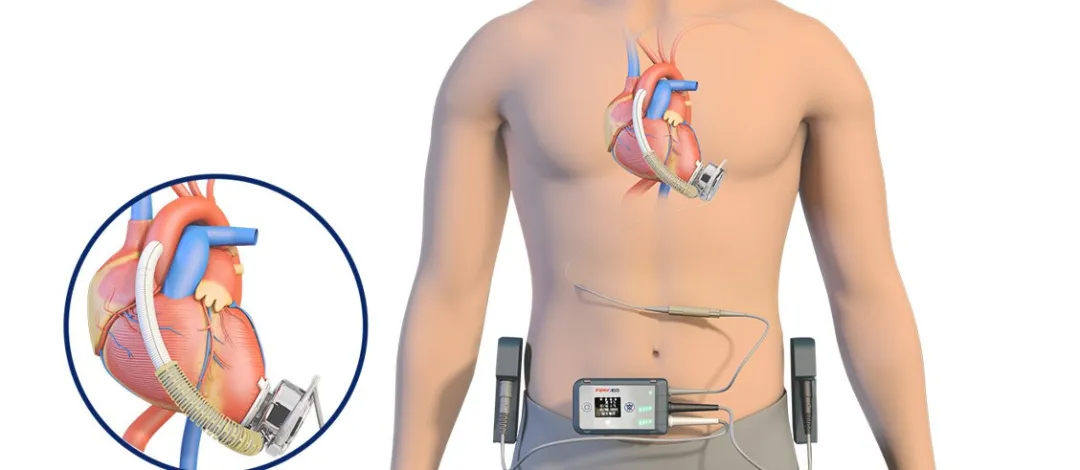
▲ Sistema de Assistência Ventricular Esquerda Implantável CH® (CH-VAD)
Desde seu lançamento, o CH-VAD foi utilizado em mais de 180 pacientes em mais de 40 dos principais hospitais cardíacos nacionais. O primeiro paciente sobreviveu por mais de 6 anos e continua a levar uma vida de alta qualidade. O CH-VAD possui um sistema completo de direitos de propriedade intelectual independente construído desde o início e obteve proteção por patente na China, Estados Unidos, Europa, Japão e outras regiões e países.
Em abril de 2024, no simpósio "Spin Doctors and Heart Hotties: Unleashing the Future of MCS Devices" da ISHLT, o Professor Xianqiang Wang do Hospital Fuwai, Academia Chinesa de Ciências Médicas, apresentou os resultados de acompanhamento de longo prazo do CH-VAD no cenário internacional. Neste estudo observacional retrospectivo de centro único, pacientes com insuficiência cardíaca em estágio terminal tratados com CH-VAD mostraram altas taxas de sobrevivência e baixas taxas de complicações, sem casos de trombose da bomba, acidentes vasculares cerebrais incapacitantes ou falhas graves no dispositivo.
Objetivos da Pesquisa
Para avaliar mais a eficácia e a segurança a longo prazo do CH-VAD, o Hospital Fuwai conduziu este estudo observacional retrospectivo de centro único, incluindo pacientes com insuficiência cardíaca tratados com CH-VAD de junho de 2017 a agosto de 2023, para analisar estatisticamente seus dados clínicos e prognóstico a longo prazo.
Métodos de Pesquisa
O estudo incluiu 50 pacientes com durações de acompanhamento variando de 3 meses a 6,7 anos. A duração média de suporte da bomba para os pacientes foi de 2,4 anos, e todos os 50 pacientes realizaram com sucesso a implantação do LVAD. A operação da bomba de sangue dos pacientes foi estável tanto intraoperatória quanto pós-operatória, e a hemodinâmica retornou ao normal.
Resultados da Pesquisa
Usando a análise de sobrevivência Kaplan-Meier, as taxas de sobrevivência de 1 ano, 2 anos e 3 anos dos pacientes foram 93%, 93% e 89%, respectivamente, todas superiores às observadas em estudos clínicos internacionais e em ambientes reais. Entre os 50 pacientes, apenas 2 foram submetidos ao transplante cardíaco como ponte. Três pacientes tiveram sua função cardíaca completamente restaurada e o LVAD removido.
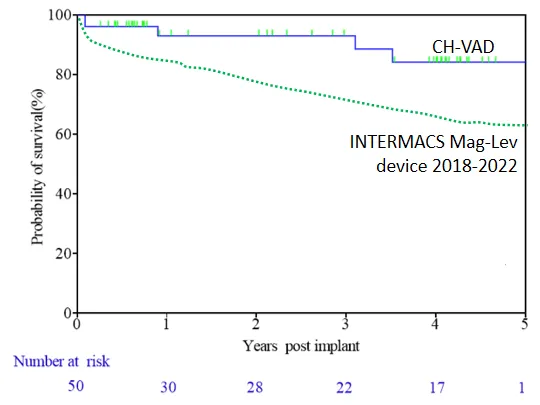
▲ Sobrevivência dos pacientes durante o acompanhamento
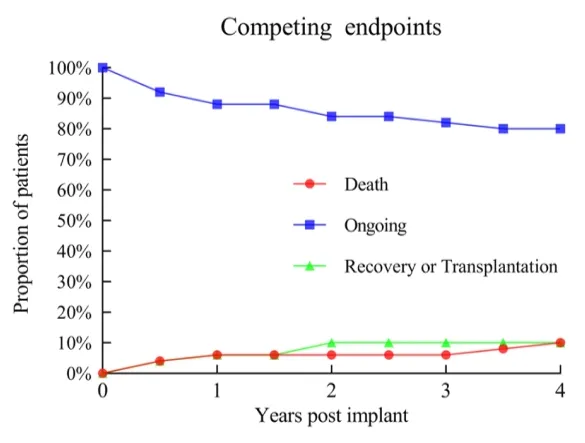
▲ Incidência de eventos para diferentes desfechos
Neste estudo, a taxa geral de incidência de eventos adversos foi baixa. A excelente compatibilidade sanguínea do CH-VAD foi refletida, sem casos observados de trombose da bomba, hemólise ou eventos de acidente vascular cerebral incapacitantes.
Entre todos os pacientes, apenas 2 experimentaram acidentes vasculares cerebrais isquêmicos (0,02 por ano-pessoa) e 1 experimentou um acidente vascular cerebral hemorrágico (0,01 por ano-pessoa), com todas as funções neurológicas dos pacientes se recuperando durante o acompanhamento. O evento adverso mais comum foi a infecção pós-operatória, que foi efetivamente prevenido e controlado com a acumulação de experiência de gestão interdisciplinar, levando a um bom prognóstico para a grande maioria dos pacientes. Não houve falhas graves no dispositivo ou cirurgias de substituição de bomba durante o período de acompanhamento, indicando alta confiabilidade a longo prazo do dispositivo.
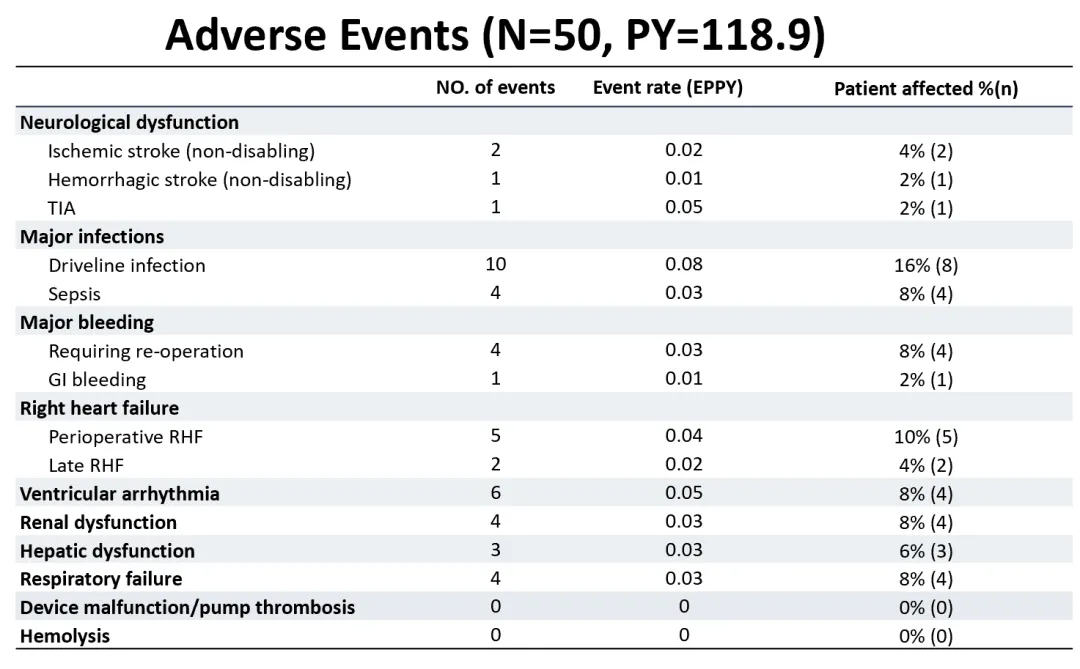
▲ Incidência de vários tipos de eventos adversos
Em 15 de abril de 2024, a FDA dos EUA anunciou um recall dos sistemas de assistência ventricular esquerda implantáveis HeartMate II e HeartMate 3 da Abbott/Thoratec devido a ocorrências de Obstrução do Enxerto de Saída Extrínseco (EOGO) causadas por forças externas. Este recall afetou 13.883 dispositivos, representando 56% dos produtos do mercado, com uma taxa estimada de ocorrência Kaplan-Meier de 0,24% em 2 anos e 2,06% em 5 anos para EOGO do HeartMate 3.
Os incidentes de EOGO envolvendo o HeartMate II e o HeartMate 3 neste recall não são novos para a indústria. Até o momento, a FDA recebeu inúmeros relatórios de eventos adversos relacionados ao EOGO com o HeartMate, totalizando 273 eventos de lesões e 14 eventos de morte.
Vale ressaltar: Primeiramente, um recall de Classe I pela FDA para dispositivos médicos não significa a cessação da produção ou uso do produto, mas sim ações corretivas para os problemas identificados, e os dispositivos continuarão a ser usados em ambientes clínicos. Em segundo lugar, a razão para o recall de Classe I do HeartMate II e HeartMate 3 pela FDA é o EOGO, que é causado pela densa capa de reforço em PTFE do HeartMate II e HeartMate 3, resultando na acumulação de biomaterial não celular exsudado, forçando o vaso sanguíneo artificial a se comprimir para dentro. No entanto, os dispositivos LVAD domésticos representados pelo CH-VAD resolveram os defeitos de design do HeartMate através do design oco da capa de reforço.
A tecnologia de levitação magnética permite rotação estável sem a necessidade de condições líquidas, reduzindo significativamente o dano ao sangue e, assim, diminuindo a ocorrência de complicações relacionadas, como trombose e acidente vascular cerebral. O CH-VAD alcança suspensão estável em cinco graus de liberdade nos eixos X, Y e Z ao dispor o estator do motor e o estator de levitação magnética nos lados interno e externo do rotor, garantindo boa resistência a choques e operação estável a longo prazo, reduzindo o dano ao sangue. Simultaneamente, o design otimizado do canal de fluxo garante um fluxo sanguíneo suave do tubo de entrada até a posição do impulsor através de um cone nasal, com um canal de fluxo secundário em forma de U com uma lacuna de 250μm, garantindo tanto um fluxo sanguíneo suave quanto bons efeitos de lavagem.
O Professor Zengsheng Chen da Universidade Beihang enfatizou uma vez que o "culpado" deste recall está na densa capa de reforço em PTFE do HeartMate II e HeartMate 3, enquanto os dispositivos LVAD domésticos representados pelo CH-VAD resolveram o problema de compressão do vaso artificial através do design oco da capa de reforço.
Os VADs de hoje são bombas implantáveis de última geração. Tome o CH-VAD, por exemplo. Ele é equipado com um impulsor notável, uma única peça móvel que impulsiona o sangue em uma única direção. Suspenso por ímãs, este impulsor opera sem atrito e não possui componentes sujeitos a desgaste.
Os impulsores desempenham um papel crucial nos VADs. Quando a corrente passa pelos ímãs, o impulsor começa a girar. O sangue é puxado para o centro do impulsor sob pressão negativa, e suas lâminas rotativas aceleram rapidamente o sangue do centro para as bordas externas. Esse sangue transformado, agora sob pressão positiva, flui para fora da bomba através do bocal de descarga para o canhão de saída.
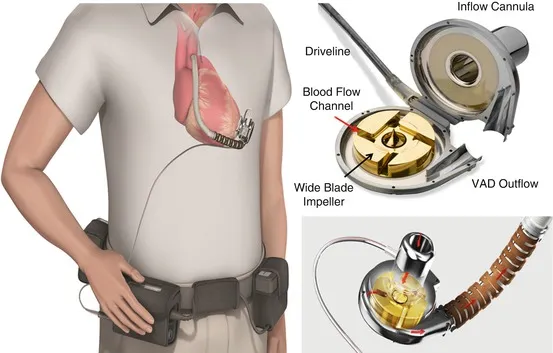
▲ O impulsor da bomba de sangue no VAD
O design do impulsor é fundamental. Segurado por ímãs e rolamentos especializados, ele gira suavemente sem tocar nas laterais. Este design não apenas minimiza danos, mas também garante a longevidade do dispositivo.
Na Manners Technology, somos especializados na fabricação de peças para dispositivos médicos, incluindo impulsores para VADs. Nosso compromisso com a qualidade é evidenciado pelas nossas certificações, incluindo ISO 9001:2015 e ISO 13485.
Estamos também colaborando com uma empresa líder da Alemanha para desenvolver impulsores ainda mais eficientes e confiáveis para VADs. Juntos, nos esforçamos para produzir peças que superem as expectativas. Se você precisar de peças especializadas ou assistência com designs, nossos serviços personalizados estão à sua disposição para atender às suas necessidades.